Cara Menuliskan Konfigurasi Elektron
Konfigurasi elektron merupakan penataan elektron ke dalam kulit dan subkulit suatu atom. Dan diagram orbital adalah diagram yang menunjukkan posisi suatu elektron dalam orbital yang ada dalam subkulit atom beserta arah rotasinya.
Dalam menuliskan konfigurasi elektron dan diagram orbital suatu atom, kita berpedoman pada 3 aturan, yaitu aturan aufbau, asas larangan pauli dan aturan hund.
Aturan Aufbau
Aufbau berarti membangun. Menurut aturan ini, pengisian elektron dimulai dari subkulit dengan tingkat energi terendah kemudian subkulit dengan tingkat energi yang lebih tinggi.
Tingkat energi suatu subkulit ditentukan berdasarkan nilai bilangan kuantum utama (n) dan bilangan kuantum azimut (l).

Berdasarkan ketentuan ini dapat diketahui bahwa :
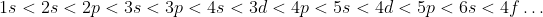
Saat menuliskan konfigurasi elektron, kita mendistribusikan elektron yang ada ke subkulit 1s terlebih dahulu, kemudian ke subkulit 2s, dan seterusnya.
Asas Larangan Pauli
Asas ini menyatakan bahwa, "Tidak boleh ada 2 elektron yang mempunyai nilai keempat bilangan kuantum yang sama". Jadi, sebuah orbital maksimum bisa terisi oleh 2 elektron dengan arah spin yang berbeda.
Aturan Hund
Menurut aturan ini, pengisian elektron pada orbital-orbital setingkat (berada di subkulit yang sama) adalah satu per satu dengan arah spin sama, sebelum berpasangan.
Contoh :
17Cl
Semoga Bermanfaat!
Pembahasan lebih lengkap dapat dibaca dalam tulisan di Blog KimiaMath: Menuliskan Konfigurasi Elektron.
Dalam menuliskan konfigurasi elektron dan diagram orbital suatu atom, kita berpedoman pada 3 aturan, yaitu aturan aufbau, asas larangan pauli dan aturan hund.
Aturan Aufbau
Aufbau berarti membangun. Menurut aturan ini, pengisian elektron dimulai dari subkulit dengan tingkat energi terendah kemudian subkulit dengan tingkat energi yang lebih tinggi.
Tingkat energi suatu subkulit ditentukan berdasarkan nilai bilangan kuantum utama (n) dan bilangan kuantum azimut (l).
Berdasarkan ketentuan ini dapat diketahui bahwa :
Saat menuliskan konfigurasi elektron, kita mendistribusikan elektron yang ada ke subkulit 1s terlebih dahulu, kemudian ke subkulit 2s, dan seterusnya.
Asas Larangan Pauli
Asas ini menyatakan bahwa, "Tidak boleh ada 2 elektron yang mempunyai nilai keempat bilangan kuantum yang sama". Jadi, sebuah orbital maksimum bisa terisi oleh 2 elektron dengan arah spin yang berbeda.
Aturan Hund
Menurut aturan ini, pengisian elektron pada orbital-orbital setingkat (berada di subkulit yang sama) adalah satu per satu dengan arah spin sama, sebelum berpasangan.
Contoh :
17Cl
- Konfigurasi elektron
17Cl : 1s2 2s2 2p6 3s2 3p5 - Diagram orbital

Semoga Bermanfaat!
Pembahasan lebih lengkap dapat dibaca dalam tulisan di Blog KimiaMath: Menuliskan Konfigurasi Elektron.
Comments